L'atome, de Démocrite à la physique quantique
400 ans av. J-C - L'atome de DÉMOCRITE
C'est dans l'antiquité grecque, vers 400 ans av. J-C, que la notion d'atome apparaît avec le philosophe Démocrite.
En dehors de toute observation expérimentale, il fait l'hypothèse que la matière est composée de particules élémentaires, indivisibles qu'il nomme atomes[1].
Pour Démocrite, les atomes sont éternels et immuables. Il explique la variété des matières qui nous entoure par l'infinité de formes que peuvent prendre les atomes.
L'opposition d'Aristote à cette intuition conduit à l'abandon de la notion d'atome. La matière reste donc constituée de quatre "éléments" : le feu, l'air, la terre et l'eau.
1805 - L'atome selon John DALTON
1897 - L'atome selon THOMSON
Thomson est le premier à découvrir les composants de l'atome et à les différencier selon leur charge électrique. Il met en évidence la présence des électrons[2] et montre que ces particules sont chargées négativement.
L'atome étant neutre, il propose un modèle où la charge positive est répartie dans une sphère parsemée d'électrons chargés négativement, à la manière d'un pudding.

1911 - Rutherford, Bohr, Planck - L'atome et son noyau
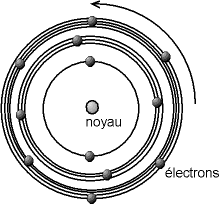
Au début du XXème siècle, les modèles de l'atome font apparaître deux zones bien distinctes : le noyau qui contient l'ensemble des charges positives et le nuage électronique qui contient les électrons[2].
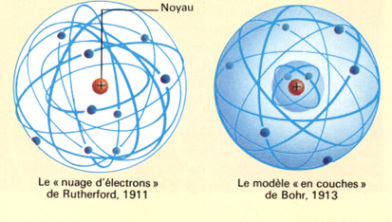
Différents modèles vont cohabiter. Pour Rutherford, les électrons sont répartis dans un nuage autour du noyau, alors que Bohr propose un modèle faisant intervenir la notion de couche électronique.
Ces modèles ont par la suite été mis en défaut par des observations expérimentales dont ils ne pouvaient pas rendre compte.
Ci-dessous une animation sur l'expérience de Rutherford ayant conduit à la découverte du noyau des atomes.
L'atome aujourd'hui, les apports de la physique quantique
La description de l'atome a considérablement évolué au cours de la deuxième moitié du XXème siècle avec le développement de la mécanique quantique.
On ne parle plus de trajectoire de l'électron autour du noyau, mais de probabilité de présence des électrons dans certaines zones autour du noyau. Ces nouveaux concepts ont ouvert la voie à une nouvelle physique dont les implications commencent à peine à rejaillir dans des technologies quotidiennes.
La vision quantique de l'atome d'hydrogène et de ses couches et sous-couches électroniques : les orbitales.
La couleur est liée à la probabilité de présence de l'électron dans la zone concernée.







