Les relations indispensables en chimie
Introduction
L'exploitation quantitative des réactions chimiques fait appel à la quantité de matière, exprimée en moles, des espèces chimiques entrant dans la composition du système.
Il n'existe pas d'appareil de mesure permettant d'accéder directement et de manière universelle à la quantité de matière d'une espèce chimique dans un système. Il est donc essentiel de pouvoir relier une grandeur physique mesurable (masse, pression, volume, absorbance, pH, etc...) à une quantité de matière.
Cette activité présente quelques relations indispensables à la résolution de problèmes en chimie.
Quantité de matière
Définition : Quantité de matière
En chimie, la quantité de matière d'une entité est le nombre de moles, noté n, de cette entité.
Elle est notée de la façon suivante : \(n \left(SO_4 ^{2-} \right)=0{,}032\ \mathrm {mol}\), ce qui signifie littéralement « La quantité de matière en ions \(SO_4 ^{2-}\) vaut 0,032 moles »
.
Définition : Nombre d'Avogadro
Le nombre d'Avogadro, noté \(\cal N_{\text{A}}\), correspond au nombre d'entités présentes dans une mole.
Par définition, \({\cal N_{\text{A}}}\simeq 6{,}022\times 10^{23}\ \mathrm{mol^{-1}}\).
Méthode : Relier quantité de matière n et nombre N d'entités
La quantité de matière n, exprimée en moles, est liée au nombre d'entités N par la relation :
\(n=\dfrac{N}{\cal {N_\text{A}}}\)
Masse molaire
Définition : Masse molaire d'une espèce chimique
La masse molaire d'une espèce chimique correspond à la masse d'une mole d'entités individuelles.
La plupart des classifications périodiques compilent les masses molaires atomiques, en tenant compte si besoin des proportions des différents isotopes de chaque élément.
Fondamental : Relation entre quantité de matière, masse et masse molaire
La masse molaire permet de relier la masse m d'une espèce chimique à sa quantité de matière n par la relation :
Méthode : Déterminer la masse molaire d'une espèce chimique
Dans un exercice, si la asse molaire d'une espèce chimique n'est pas donnée elle se calcule simplement à l'aide des masses molaires atomiques (données) et de la formule brute.
Exemple : \(\mathrm{H_2O}\)
La masse molaire de la molécule d'eau se calcule par \(M\left(\mathrm{H_2O}\right)=2\times M(H) + M(O)\).
Masse volumique
Définition : Masse volumique
La masse volumique d'un corps est définie comme le rapport de sa masse sur le volume qu'il occupe.
La masse volumique s'exprime dans le système international d'unités en \(\mathrm{kg \cdot m^{-3}}\).
Elle est cependant couramment exprimée en \(\mathrm{g \cdot mL^{-1}}\) ou encore en \(\mathrm{kg \cdot L^{-1}}\) qui sont les unités fréquemment rencontrées en chimie.
Densité et masse volumique
Définition : Densité
La densité est un nombre sans unité correspondant au rapport entre la masse volumique \(\rho\) du corps sur une masse volumique de référence \(\rho_0\).
Dans le cas des liquides et des solides, la masse volumique de référence est généralement celle de l'eau : \(\rho_0 \simeq 1{,}0\ \mathrm{kg \cdot L^{-1}} \simeq 1{,}0\ \mathrm{g\cdot mL^{-1}}\).
Méthode : Interprétation d'une information de densité
La donnée de la densité d s'interprète directement comme une information de masse volumique. Compte tenu de la valeur simple de la masse volumique de référence utilisée, la conversion est aisée.
Par exemple \(d=1{,}23\) s'interprète immédiatement par \(\rho = 1{,}23\ \mathbf{kg\cdot L^{-1}}=1{,}23\ \mathbf{kg\cdot L^{-1}}\).
Concentration massique ou titre massique
Définition : Concentration massique
On définit la concentration massique, ou concentration en masse, d'un soluté en solution comme le rapport de la masse m de soluté dissous sur le volume V de solution.
Remarque : Remarque sur la notation
Le titre massique est parfois notée avec la lettre grecque \(\gamma\).
Concentration en quantité de matière
Définition : Relation mathématique
On définit la concentration en quantité de matière, ou concentration molaire, d'un soluté en solution comme le rapport de sa quantité de matière n de soluté dissous sur le volume V de solution.
Fondamental : Relation entre titre massique et concentration en quantité de matière
La concentration en quantité de matière C et le titre massique t se déduisent l'un de l'autre en utilisant la masse molaire M :
Pourcentage massique
Définition : Relation mathématique
Le pourcentage massique d'une espèce chimique X dans un mélange traduit la proportion en masse de cette espèce chimique dans le mélange et s'exprime par la relation ci-dessous.
Quantité de matière d'un gaz - Volume molaire
Définition :
Le volume molaire, noté Vm et exprimé en \(\mathrm{L \cdot mol^{-1}}\), est le volume occupé par une mole de gaz.
Il ne dépend pas du gaz considéré mais dépend de la température et de la pression.
On donne ci-contre quelques valeurs à la pression ordinaire.
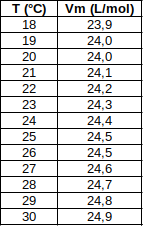
La quantité de matière d'un gaz s'exprime en fonction de son volume et du volume molaire par la relation :

