Relation à l'équivalence - Généralisation
Équation bilan de la réaction support du titrage
Dans la suite, on note A le réactif titré dont on cherche à déterminer la concentration molaire CA et B le réactif titrant dont la concentration molaire CB est connue.
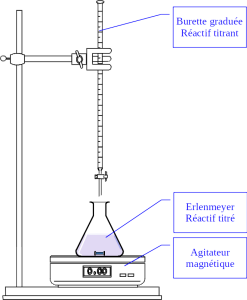
Les réactifs sont répartis comme indiqué ci-contre dans le dispositif de titrage. Il peut être nécessaire d'ajouter un indicateur coloré dans l'erlenmeyer pour permettre le repérage de l'équivalence.
On a versé dans l'erlenmeyer un volume VA connu de solution contenant le réactif titré A.
La réaction support du titrage est la suivante :
\(\large{a\ A + b\ B\ \rightarrow\ \text{produits de la réaction}}\)
a et b sont les coefficients stœchiométriques des réactifs A et B.
Relation à l'équivalence et exploitation
Lorsque l'équivalence est atteinte, on relève sur la burette graduée le volume équivalent versé \(V_{eq}\).
À l'équivalence, les réactifs sont complètement consommés, ils ont été introduits dans les proportions stœchiométriques, donc la relation entre les quantités de matière de réactif titré et de réactif titrant est :
\(\Large{\dfrac{n(A)}{a}=\dfrac{n(B)}{b}}\)
En faisant intervenir les concentrations et les volumes des solutions on a :
\(\dfrac{C_A\times V_A}{a}=\dfrac{C_B\times V_{eq}}{b}\)
La concentration inconnue CA s'exprime donc par la relation suivante :
\(\Large{C_A = \dfrac{a}{b}\times \dfrac{C_B\times V_{eq}}{V_A}}\)