Technique de spectrophotométrie - Généralisation
Cette partie généralise à d'autres solutions colorées le principe de l'analyse par spectrophotométrie en insistant notamment sur les pré-requis à la mise en oeuvre d'une telle technique.
Spectre d'absorption d'une espèce chimique colorée
C'est un élément indispensable à l'utilisation d'une technique de spectrophotométrie.
D'un point de vue qualitatif, on sait qu'une espèce chimique colorée absorbe significativement sa couleur complémentaire.
Le spectre d'absorption fournit des éléments quantitatifs permettant notamment de repérer la longueur d'onde à laquelle l'absorbance est maximale.
Définition : Spectre d'absorption
En spectrophotométrie, un spectre d'absorption est la représentation graphique des variations de l'absorbance A en fonction de la longueur d'onde \(\mathbf \lambda\) de la lumière incidente.
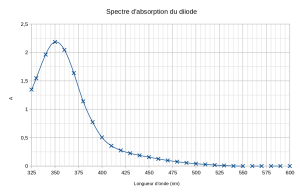
Ci-contre, le spectre d'absorption des ions permanganate \(\left(MnO_4 ^{-} \right)\). Il montre un pic d'absorption intense au niveau de la longueur d'onde \(\lambda=525\ \mathrm{nm}\).
Ce spectre est cohérent avec celui obtenu par décomposition de la lumière après traversée d'une cuve de permanganate (cliquer pour agrandir).
La connaissance du spectre d'absorption d'une espèce chimique est indispensable pour utiliser la spectrophotométrie en chimie.
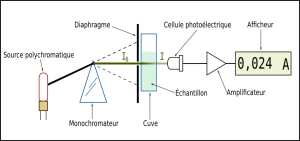
Le spectrophotomètre
Principe de fonctionnement de l'appareil
Lorsque de la lumière blanche traverse une solution colorée, un certain nombre de radiations sont absorbées, conduisant à une perception colorée sur le principe de la synthèse soustractive.
Un spectrophotomètre est un appareil qui mesure l'intensité lumineuse I traversant une solution pour une longueur d'onde donnée. La comparaison de cette intensité lumineuse avec l'intensité I0 de la lumière incidente permet de quantifier l'absorption de la lumière par la solution.
Le monochromateur permet la sélection d'une longueur d'onde précise à partir d'une source de lumière blanche.
La cellule photoélectrique permet d'accéder à la valeur de l'intensité lumineuse I.
Grandeurs mesurées
Initialement, un spectrophotomètre ne mesure que deux grandeurs : l'intensité de la lumière incidente I0 et l'intensité de la lumière transmise I.
À partir de ces deux valeurs, le spectrophotomètre peut calculer :
la transmittance T : \(T=\dfrac{I}{I_0}\), qui peut aussi s'exprimer en pourcentage. Elle traduit la proportion de lumière ayant traversé la solution.
l'absorbance A : \(A=log \left(\dfrac{I_0}{I} \right)\). C'est cette grandeur qui est la plus utilisée en chimie pour la détermination de concentrations.
Généralisation de la loi de Beer-Lambert
Expression géénralisée de la loi de Beer-Lambert
On a établi lors de la séance de travaux pratiques une relation de proportionnalité entre l'absorbance et la concentration, pour une longueur d'onde donnée, pour une espèce chimique donnée (les ions permanganate) et pour un dispositif donné.
D'une manière générale, l'absorbance A dépend de l'espèce chimique et de sa concentration en solution, de la longueur d'onde utilisée et de la longueur du trajet de la lumière dans la solution (longueur de la cuve).
Pour une espèce chimique colorée quelconque, en concentration C en solution aqueuse, la loi de Beer-Lambert s'exprime de la façon suivante :
Avec :
A l'absorbance de la solution, nombre sans unité.
\(\mathbf{\epsilon \left( \lambda \right)}\) le coefficient d'extinction molaire en \(\mathbf{L \cdot mol^{-1} \cdot cm^{-1}}\).
l, la longueur de solution traversée, en cm.
C la concentration molaire de la solution en espèce chimique en \(\mathbf{mol \cdot L^{-1}}\).
Attention : Perte de la relation de proportionnalité
Pour des solutions trop concentrées, la relation de proportionnalité cesse d'être valable. On effectue donc l'étalonnage de l'appareil avec des solutions dont les concentrations ne sont pas trop éloignées de la concentration à mesurer.
Complément : Interprétation du coefficient d'extinction molaire
Le coefficient d'extinction molaire \(\epsilon \left(\lambda \right)\) est une fonction mathématique de la longueur d'onde \(\lambda\) propre à chaque espèce chimique.
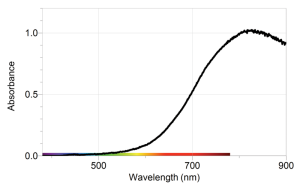
Cette fonction traduit les variations intrinsèques de l'absorbance en fonction de la longueur d'onde \(\lambda\) et elle permet de repérer les pics d'absorptions caractéristiques de l'espèce chimique étudiée.
Les allures des deux spectres d'absorption présentés ci-dessous traduisent deux fonction \(\epsilon \left(\lambda \right)\) différentes.
Méthode : Exploitation en chimie
Lorsqu'on exploite dans un protocole concret de chimie la loi de Beer-lambert \(A=\epsilon \left( \lambda \right) \times l \times C\), des simplifications apparaissent :
Pour un spectrophotomètre donné, la longueur l de solution traversée est fixe. C'est une caractéristique de l'appareil utilisé.
Pour une espèce chimique donnée, et lorsqu'on fixe la longueur d'onde de travail \(\lambda\), \(\epsilon \left(\lambda \right)\) a une valeur constante, indépendante de la concentration de la solution.
Donc, le produit \(\epsilon \left(\lambda \right) \times l\) est constant.
On retrouve alors la proportionnalité entre l'absorbance et la concentration établie lors du TP sur la solution de Dakin : \(A=k \times C\).
k est une constante liée à l'appareil utilisé, à la longueur d'onde de travail et à l'espèce chimique étudiée.
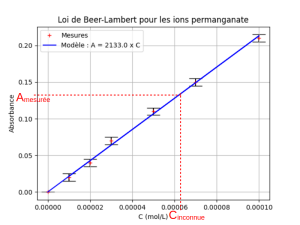
La connaissance de la relation de proportionnalité entre l'absorbance et la concentration permet une détermination quasi-immédiate, graphique ou par le calcul, d'une concentration inconnue par une mesure d'absorbance.
Ci-contre, on lit la concentration CInconnue sur le graphique ou on l'obtient par le calcul \(C_{Inconnue}=\dfrac{A_{Mesuree}}{2133}\) dans le cas de l'exemple choisi.