Nomenclature des alcènes
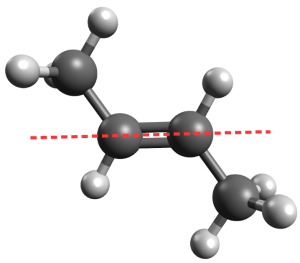
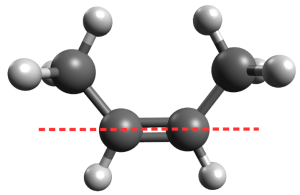
Isomérie Z/E
Nomenclature des alcènes
Méthode générale
La méthode est très proche de celle employée pour les alcanes.
À la différence d'un alcane, le nom d'un alcène se termine par le suffixe -ène.
On commence par repérer la chaîne carbonée principale (la plus longue contenant la double liaison) et on la numérote de façon à ce que la double liaison porte le numéro le plus petit possible.
Noter la position de la double liaison.
Chercher les éventuelles ramifications et noter leur position en utilisant la numérotation définie à l'étape 1.
Le cas échéant, indiquer l'isomérie de la double liaison.
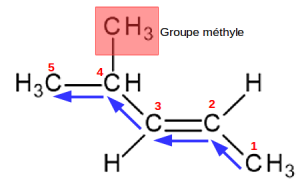
Exemple : Trouver le nom systématique d'un alcène ramifié
On repère en bleu la chaîne carbonée principale : elle comporte 5 atomes de carbone, avec une double liaison en position n°2.
Si on ne prend pas en compte la ramification, on a donc un pent-2-ène.
La chaîne carbonée se répartit de part et d'autre de l'axe de la double liaison, c'est donc l'isomère E.
Enfin, un groupe méthyle est porté par le carbone n°4.
Le nom complet de cette molécule est donc :
(E) 4-méthylpent-2-ène