Exploitation et conclusions
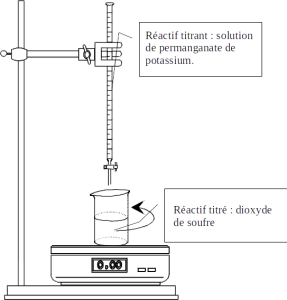
Titrage du dioxyde de soufre
Rappel : Données du titrage
On a simulé le mécanisme d'acidification d'une pluie par le dioxyde de soufre en réalisant la combustion de soufre dans un volume d'air voisin de \(1{,}0\ \mathrm L\) puis en dissolvant le dioxyde de soufre formé dans un volume de "pluie" total \(V=200{,}0\ \mathrm {mL}\).
On note \(C_{SO_2}\) la concentration molaire en dioxyde de soufre de la "pluie" : inconnue.
La concentration molaire du réactif titrant est \(C_{MnO^-_4}=5{,}0\times 10^{-3}\ \mathrm{mol \cdot L^{-1}}\).
Prise d'essai : volume de "pluie" prélevé pour le titrage : \(V_{pluie}=10{,}0\ \mathrm{mL}\).
Couple oxydant/réducteur du permanganate : \(MnO^-_{4(aq)}/Mn_{(aq)}^{2+}\).
Couple oxydant/réducteur du dioxyde de soufre : \(SO^{2-}_{4(aq)}/SO_{2(aq)}\).
Réaction support du titrage
La solution de permanganate de potassium est versée dans la burette et un volume \(V_{pluie}=10{,}0\ \mathrm{mL}\) de "pluie" à titrer est introduit dans un bécher ou erlenmeyer.
La réaction support du titrage est une réaction d'oxydoréduction entre les ions permanganate et le dioxyde de soufre. On obtient l'équation de la réaction à partir des demi-équations de chaque couple qui s'écrivent en suivant : la méthode vue dans le chapitre Oxydoréduction.
Pour les ions permanganate :
\(\mathrm{MnO^-_{4(aq)}\rightarrow Mn^{2+}_{(aq)}}\)
On équilibre l'élément chimique oxygène à l'aide de molécules d'eau :
\(\mathrm{MnO^-_{4(aq)}\rightarrow Mn^{2+}_{(aq)} + 4 H_2 O_{(l)}}\)
En milieu acide on équilibre l'élément chimique hydrogène avec des ions \(\mathrm{H^+_{(aq)}}\) :
\(\mathrm{MnO^-_{4(aq)} + 8H^+_{(aq)}\rightarrow Mn^{2+}_{(aq)} + 4 H_2 O_{(l)}}\)
On équilibre enfin la charge électrique à l'aide d'électrons :
\(\mathrm{MnO^-_{4(aq)} + 8H^+_{(aq)} + 5e^-\rightarrow Mn^{2+}_{(aq)} + 4 H_2 O_{(l)}}\)
Pour le dioxyde de soufre :
\(\mathrm{SO_{2(aq)}\rightarrow SO^{2-}_{4(aq)}}\)
En équilibrant l'élément oxygène :
\(\mathrm{SO_{2(aq)} + 2H_2 O_{(l)}\rightarrow SO^{2-}_{4(aq)}}\)
En équilibrant l'élément hydrogène :
\(\mathrm{SO_{2(aq)} + 2H_2 O_{(l)}\rightarrow SO^{2-}_{4(aq)}+4H^+_{(aq)}}\)
Enfin, en équilibrant la charge électrique :
\(\mathrm{SO_{2(aq)} + 2H_2 O_{(l)}\rightarrow SO^{2-}_{4(aq)}+4H^+_{(aq)} + 2e^-}\)
L'équation de la réaction support du titrage s'obtient en combinant les demi-équations de façon à mettre en jeu le même nombre d'électrons dans l'oxydation et dans la réduction :
\(\Large{2\mathrm{MnO^{-}_{4(aq)}} + 5\mathrm{SO_{2(aq)}} + 2\mathrm{H_2 O_{(l)}}\rightarrow 2\mathrm{Mn^{2+}_{(aq)}} + 5\mathrm{SO_{4(aq)}^{2-}} + 4\mathrm{H^+_{(aq)}}}\)
Repérage de l'équivalence et exploitation
Lors du titrage, on fait les observations suivantes :
en début de titrage, la coloration fuchsia de la solution de permanganate ne persiste pas dans le bécher : les ions permanganate sont le réactif limitant, ils sont complètement consommés.
si on continue de verser la solution de permanganate de potassium, la coloration fuchsia finit par persister dans le bécher : les ions permanganate ont complètement consommé le dioxyde de soufre initialement présent, il est devenu le réactif limitant.
L'équivalence du titrage correspond au changement de réactif limitant. On la repère dès que la coloration des ions permanganate persiste dans le bécher, à la goutte près.
On note la valeur du volume versé à l'équivalence : \(V_{eq} = 5{,}20\ \mathrm{mL}\). (Exemple de résultat obtenu, cela ne correspond pas nécessairement à ce que vous avez mesurés lors du TP).
À l'équivalence, les réactifs ont été introduits dans les proportions stœchiométriques de l'équation de la réaction support du titrage, soit :
\(\large{\dfrac{n_{MnO^{-}_4}}{2} = \dfrac{n_{SO_2}}{5}}\).
En faisant intervenir les données du titrage (concentrations et volumes), on peut écrire :
\(\dfrac{C_{MnO^{-}_4}\times V_{eq}}{2}=\dfrac{C_{SO_2}\times V_{pluie}}{5}\).
On exprime donc la concentration inconnue :
\(C _{ SO_2}=\dfrac{5 \times C_{MnO^{-}_4}\times V_{eq}}{2 \times V_{pluie}}\)
Application numérique :
\(C_{SO_2}=\dfrac{5 \times 5{,}0\times 10^{-3}\times5{,}20}{2 \times 10{,}0}\simeq6{,}50\times 10^{-3}\ \mathrm{mol\cdot L^{-1}}\).
La concentration molaire en dioxyde de soufre dissous dans la "pluie" fabriquée est donc \(C_{SO_2}\simeq6{,}50\times 10^{-3}\ \mathrm{mol\cdot L^{-1}}\)
Le nombre de chiffres significatifs du résultat sera ajusté en fonction de l'estimation de l'incertitude dans la partie suivante.
Estimation de l'incertitude sur la concentration en dioxyde de soufre
Dans cette partie, on s'intéresse à l'estimation de l'incertitude type sur la valeur de la concentration en dioxyde de soufre déterminée lors du titrage.
On prend en compte l'ensemble des incertitudes dues à la verrerie et au protocole, en supposant que les prélèvements et les lectures ont été faites avec la plus grande précision possible par les expérimentateurs.
Méthode : Fiche de traitement des incertitudes à compléter
La fiche téléchargeable ci-dessous rappelle les sources d'incertitude à prendre en compte ainsi que les relations mathématiques permettant de les calculer. Ces relations ne sont pas à connaître, mais vous devez savoir effectuer toutes les applications numériques et interpréter correctement la valeur d'une incertitude type.
Fiche complétée à partir d'un exemple de résultat
La fiche ci-dessous est complétée avec les valeurs de l'équivalence utilisées plus haut.
Méthode : Écriture du résultat final
Sans arrondi, concentration molaire en dioxyde de soufre peut s'écrire : \(C_{SO_2}=6{,}5000 \times 10^{-3}\ \mathrm{mol \cdot L^{-1}}\).
L'incertitude type calculée est \(u \left(C_{SO_2} \right)=5{,}5172\times 10^{-5}\ \mathrm{mol \cdot L^{-1}}\).
On arrondit cette valeur finale à un seul chiffre significatif : \(u \left(C_{SO_2} \right)=6\times 10^{-5}\ \mathrm{mol \cdot L^{-1}}\).
Le chiffre de plus grande précision sur l'incertitude correspond à l'ordre de grandeur \(10^{-5}\), donc le dernier chiffre significatif du résultat doit être celui correspondant à ce même ordre de grandeur.
En accord avec la précision du dernier chiffre significatif de l'incertitude, on écrira donc le résultat final sous la forme :
\(C_{SO_2}=6{,}50 \times 10^{-3}\ \mathrm{mol \cdot L^{-1}}\) avec l'incertitude type associée \(u\left(C_{SO_2} \right)=5\times 10^{-5}\ \mathrm{mol \cdot L^{-1}}\).