Exercice : Niveaux d'énergie d'un atome et radiation lumineuse
Il s'agit dans cet exercice de relier la couleur de la radiation émise à une transition entre deux niveaux d'énergie de l'atome.
Question
On donne les énergies de quelques niveaux de l’atome de mercure sur le diagramme ci-contre.
Déterminer la fréquence \(\mathbf{\nu}\) et la longueur d’onde \(\mathbf{\lambda}\) du photon émis lors de la transition \(E_5 \rightarrow E_4\).
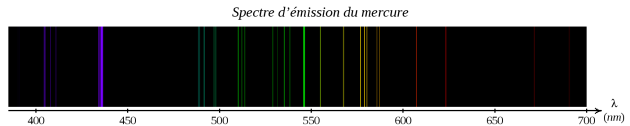
Identifier la raie concernée sur le spectre de l'atome de mercure rappelé ci-dessous.
Solution
Éléments de correction
on commence par calculer l'écart d'énergie entre ces deux niveaux : \(\Delta E=E_5-E_4\)
\(\Delta E=-0{,}90+3{,}73=2{,}83\ \mathrm{eV}\)
La relation de Planck-Einstein utilise les unités du système international, on convertit donc cette énergie en joule :
\(\Delta E=2{,}83\times 1{,}602\times 10^{-19}\simeq 4{,}53\times 10^{-19}\ \mathrm J\)
\(\Delta E = E_{photon}=h \cdot \nu = h \cdot \dfrac{c}{\lambda}\)
donc \(\nu=\dfrac{\Delta E}{h}\) et \(\lambda=\dfrac{h\cdot c}{\Delta E}\)
Numériquement :
\(\nu=\dfrac{4{,}53\times 10^{-19}}{6{,}63\times 10^{-34}}\simeq 6{,}83\times 10^{14}\ \mathrm{Hz}\)
\(\lambda=\dfrac{6{,}63\times 10^{-34}\times 3\times 10^8}{4{,}53\times 10^{-19}}\simeq 4{,}39\times 10^{-7}\ \mathrm m \simeq 439\ \mathrm{nm}\)
Cette radiation correspond à la raie violette sur le spectre d'émission de l'atome de mercure.