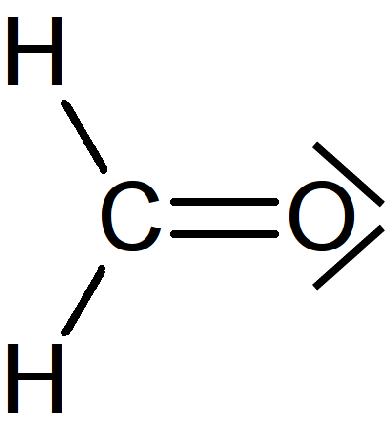Exercice : Représentation de Lewis de la molécule de méthanal
Question
La molécule de méthanal a pour formule brute CH2O.
Les numéros atomiques des atomes concernés sont :
C : \(Z=6\)
O : \(Z=8\)
H : \(Z=1\)
Établir la formule de Lewis de la molécule.
(La solution commentée est disponible ci-dessous).
Solution
On commence par déterminer la valence des atomes entrant dans la composition de la molécule.
La structure électronique de l'atome de carbone est \(1s^22s^22p^2\). Il possède 4 électrons de valence, donc sa valence est \(v=8-4=4\).
La structure électronique de l'atome d'oxygène est \(1s^22s^22p^4\). Il possède 6 électrons de valence, donc sa valence est \(v=8-6=2\).
L'atome d'hydrogène a une valence égale à 1.
Le nombre d'électrons périphériques total sur la molécule est \(n_t=\underbrace {4}_{C}+\underbrace 6_O+\underbrace{2\times1}_{2\ H}=12\).
Soit un nombre de doublet à répartir sur la molécule : \(n_d = \dfrac{12}{2}=6\)
On établit les liaisons covalentes entre les atomes en respectant leur valence.
La seule configuration possible est la suivante, en utilisant 4 doublets de liaison.
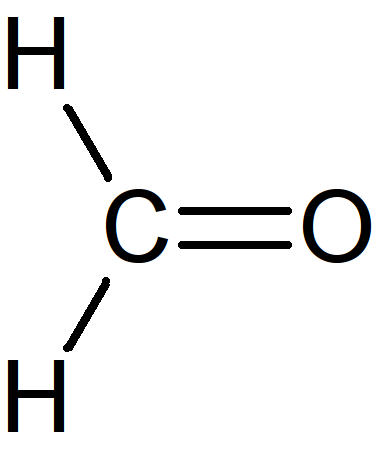
Il reste à placer 2 doublets sur les atomes de façon à respecter la règle de l'octet.
L'atome de carbone est entouré de 4 doublets de liaison, donc de 8 électrons. Aucun doublet non-liant n'est nécessaire.
Pour l'atome d'oxygène, les deux doublets de liaison (liaison covalente double) lui apportent 4 électrons. Il lui en manque encore 4 pour respecter la règle de l'octet. Il possède donc 2 doublets non-liants.
La formule de Lewis de cette molécule est donc la suivante :